Naast technologie is de synthese van glycosiden altijd interessant geweest voor de wetenschap, omdat het een veelvoorkomende reactie in de natuur is. Recente artikelen van Schmidt, Toshima en Tatsuta, evenals de vele daarin aangehaalde referenties, hebben een breed scala aan synthetische mogelijkheden besproken.
Bij de synthese van glycosiden worden componenten met meerdere suikers gecombineerd met nucleofielen, zoals alcoholen, koolhydraten of eiwitten. Indien een selectieve reactie met een van de hydroxylgroepen van een koolhydraat vereist is, moeten alle andere functies in de eerste stap worden beschermd. In principe kunnen enzymatische of microbiële processen, dankzij hun selectiviteit, complexe chemische beschermings- en deprotectiestappen vervangen om glycosiden selectief te verwijderen. Vanwege de lange geschiedenis van alkylglycosiden is de toepassing van enzymen bij de synthese van glycosiden echter nog niet uitgebreid onderzocht en toegepast.
Vanwege de capaciteit van geschikte enzymsystemen en de hoge productiekosten is de enzymatische synthese van alkylpolyglycosiden nog niet klaar voor een industriële toepassing. In plaats daarvan wordt de voorkeur gegeven aan chemische methoden.
In 1870 rapporteerde Macolley de synthese van “acetochlorhydrose” (1, figuur 2) door de reactie van dextrose (glucose) met acetylchloride, wat uiteindelijk leidde tot de geschiedenis van glycoside-syntheseroutes.
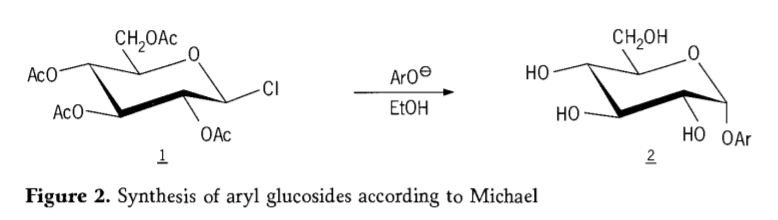
Tetra-O-acetylglucopyranosylhalogeniden (acetohaloglucoses) bleken later bruikbare tussenproducten te zijn voor de stereoselectieve synthese van zuivere alkylglucosiden. In 1879 slaagde Arthur Michael erin om duidelijke, kristalliseerbare arylglycosiden te bereiden uit Colley's tussenproducten en fenolaten (Aro-, figuur 2).
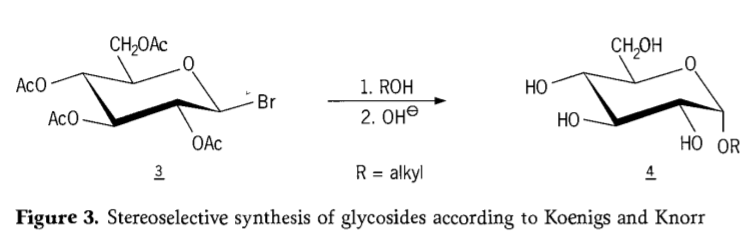
In 1901 introduceerde Michaels synthese een breed scala aan koolhydraten en hydroxyl-aglyconen, toen W. Koenigs en E. Knorr hun verbeterde stereoselectieve glycosideringsproces introduceerden (Figuur 3). De reactie omvat een SN2-substitutie op het anomere koolstofatoom en verloopt stereoselectief met inversie van de configuratie, waarbij bijvoorbeeld α-glucoside 4 wordt geproduceerd uit het β-anomeer van aceobromoglucose-intermediair 3. De Koenigs-Knorr-synthese vindt plaats in aanwezigheid van zilver- of kwikpromotoren.
In 1893 stelde Emil Fischer een fundamenteel andere aanpak voor de synthese van alkylglucosiden voor. Dit proces staat nu bekend als de "Fischer-glycosidatie" en omvat een zuurgekatalyseerde reactie van glycosen met alcoholen. Een historisch verslag zou echter ook A. Gautiers eerste poging uit 1874 moeten omvatten, om dextrose om te zetten met watervrije ethanol in aanwezigheid van zoutzuur. Door een misleidende elementanalyse dacht Gautier dat hij een "diglucose" had verkregen. Fischer toonde later aan dat Gautiers "diglucose" in feite voornamelijk ethylglucoside was (figuur 4).
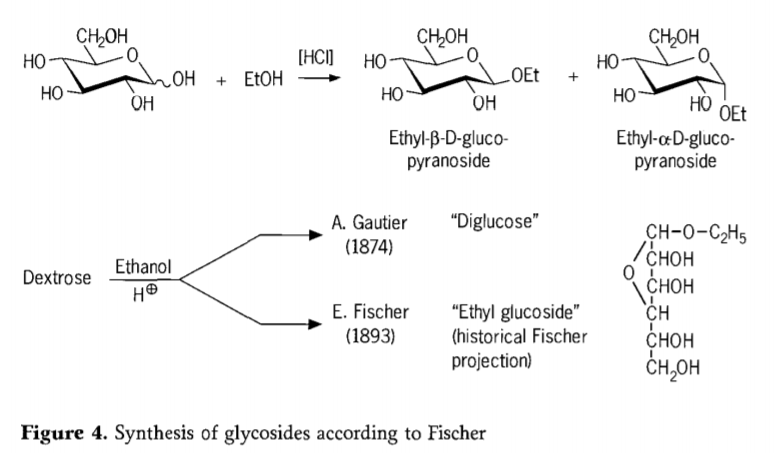
Fischer definieerde de structuur van ethylglucoside correct, zoals blijkt uit de voorgestelde historische furanosidische formule. Fischers glycosidatieproducten zijn in feite complexe, meestal evenwichtsmengsels van α/β-anomeren en pyranoside/furanoside-isomeren, die ook willekeurig gekoppelde glycoside-oligomeren bevatten.
Daarom zijn individuele moleculaire soorten niet gemakkelijk te isoleren uit Fischer-reactiemengsels, wat in het verleden een ernstig probleem was. Na enige verbetering van deze synthesemethode paste Fischer vervolgens de Koenigs-Knorr-synthese toe voor zijn onderzoek. Met behulp van dit proces waren E. Fischer en B. Helferich de eersten die in 1911 de synthese rapporteerden van een langketenige alkylglucoside met oppervlakteactieve eigenschappen.
Al in 1893 had Fischer de essentiële eigenschappen van alkylglycosiden terecht opgemerkt, zoals hun hoge oxidatie- en hydrolysebestendigheid, vooral in sterk alkalische media. Beide eigenschappen zijn waardevol voor alkylpolyglycosiden in oppervlakteactieve toepassingen.
Onderzoek naar de glycosideringsreactie is nog steeds gaande en er zijn de laatste tijd verschillende interessante routes naar glycosiden ontwikkeld. Enkele procedures voor de synthese van glycosiden zijn samengevat in Figuur 5.
Algemeen gesproken kunnen chemische glycosideringsprocessen worden onderverdeeld in processen die leiden tot complexe oligomeer-evenwichten bij zuur-gekatalyseerde glycosyluitwisseling.
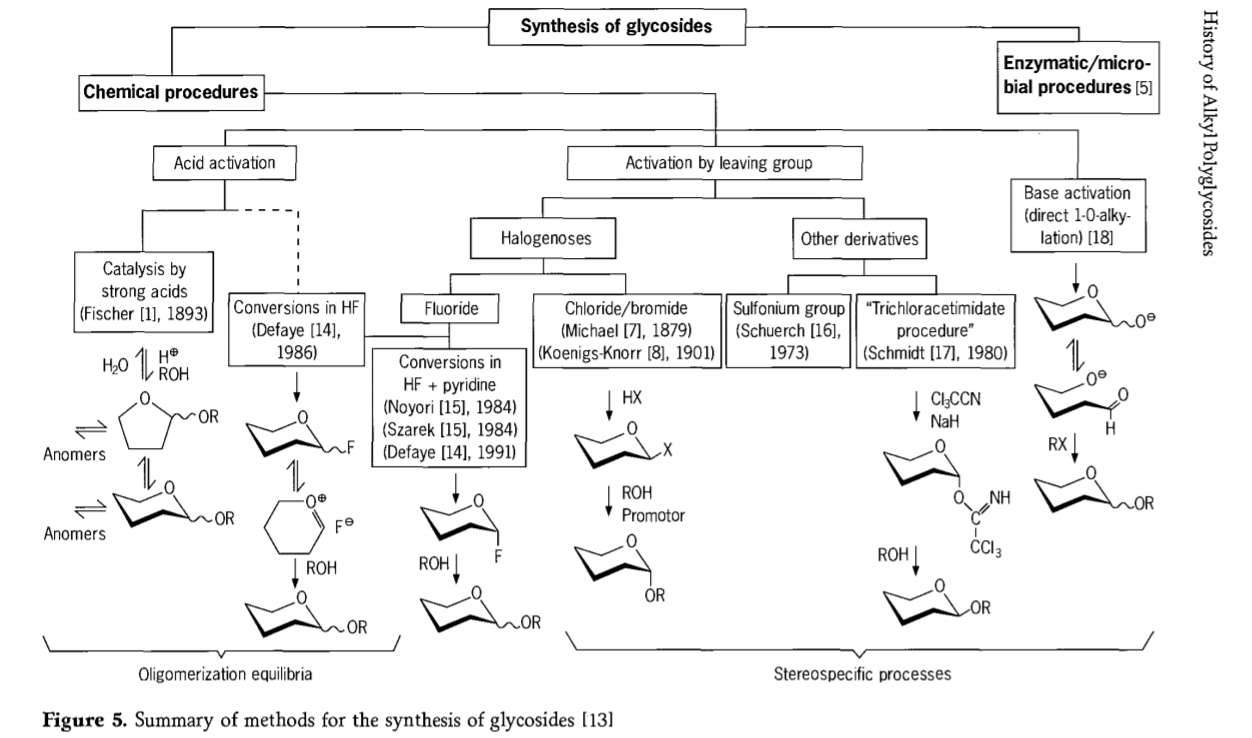
Reacties op correct geactiveerde koolhydraatsubstraten (Fischer-glycosidische reacties en waterstoffluoride (HF)-reacties met onbeschermde koolhydraatmoleculen) en kinetisch gecontroleerde, onomkeerbare en voornamelijk stereotactische substitutiereacties. Een tweede type procedure kan leiden tot de vorming van individuele soorten in plaats van complexe mengsels van reacties, vooral in combinatie met conserveringsgroeptechnieken. Koolhydraten kunnen groepen achterlaten op het ectopische koolstofatoom, zoals halogeenatomen, sulfonylen of trichlooracetimidaatgroepen, of worden geactiveerd door basen vóór de omzetting in triflatesters.
In het specifieke geval van glycosidaties in waterstoffluoride of in mengsels van waterstoffluoride en pyridine (pyridiniumpoly[waterstoffluoride]) worden glycosylfluoriden in situ gevormd en soepel omgezet in glycosiden, bijvoorbeeld met alcoholen. Waterstoffluoride bleek een sterk activerend, niet-afbrekend reactiemedium te zijn; evenwichtsautocondensatie (oligomerisatie) wordt waargenomen, vergelijkbaar met het Fischer-proces, hoewel het reactiemechanisme waarschijnlijk verschilt.
Chemisch zuivere alkylglycosiden zijn alleen geschikt voor zeer speciale toepassingen. Zo zijn alkylglycosiden succesvol gebruikt in biochemisch onderzoek naar de kristallisatie van membraaneiwitten, zoals de driedimensionale kristallisatie van porine en bacteriorodopsine in aanwezigheid van octyl β-D-glucopyranoside (verdere experimenten op basis van dit werk leidden in 1988 tot de Nobelprijs voor scheikunde voor Deisenhofer, Huber en Michel).
Tijdens de ontwikkeling van alkylpolyglycosiden zijn stereoselectieve methoden op laboratoriumschaal gebruikt om diverse modelstoffen te synthetiseren en hun fysisch-chemische eigenschappen te bestuderen. Vanwege hun complexiteit, de instabiliteit van tussenproducten en de hoeveelheid en het kritische karakter van procesverspilling, zouden syntheses van het Koenigs-Knorr-type en andere beschermende-groeptechnieken aanzienlijke technische en economische problemen opleveren. Fischer-achtige processen zijn relatief minder gecompliceerd en gemakkelijker uit te voeren op commerciële schaal en zijn daarom de voorkeursmethode voor de productie van alkylpolyglycosiden op grote schaal.
Plaatsingstijd: 12-09-2020





